CE認(rèn)證是歐盟的產(chǎn)品安全認(rèn)證���,所有進(jìn)入歐盟市場(chǎng)的醫(yī)療器械都必須進(jìn)行醫(yī)療器械CE認(rèn)證���,醫(yī)療器械需要滿足的CE指令有《有源植入性醫(yī)療器械指令》(AIMDD, 90/385/EEC)��、《醫(yī)療器械指令》(MDD,93/42/EEC)和《體外診斷器械指令》(IVDD, 98/79/EC)����。
醫(yī)療器械CE認(rèn)證包括哪四方面 ?
CE認(rèn)證是一個(gè)完善的安全保障系統(tǒng),并非僅僅是將一個(gè)樣品拿到試驗(yàn)室檢驗(yàn)通過而已��。
因?yàn)?CE 標(biāo)志是一個(gè)安全標(biāo)志���,所以�,一個(gè)通過CE認(rèn)證的產(chǎn)品必須確保自產(chǎn)品 的設(shè)計(jì)���,生產(chǎn)���,包裝,說明書的編寫���,到運(yùn)輸���,銷售,產(chǎn)品的整個(gè)有效使用壽命 中�����,以及使用后產(chǎn)品的回收�,等等所有環(huán)節(jié)中,均符合歐洲的健康�����、安全、與 環(huán)境保護(hù)之相關(guān)法律中所規(guī)定的基本要求���。因此����,一家制造商欲想使其產(chǎn)品通過 CE認(rèn)證���,通常要滿足如下4方面的要求:
1.產(chǎn)品投放到歐洲市場(chǎng)前��,在產(chǎn)品上加貼CE標(biāo)簽�����。
2.產(chǎn)品投放到歐洲市場(chǎng)后����,技術(shù)文件(Technical Files)必須存放于歐盟境 內(nèi)供監(jiān)督機(jī)構(gòu)隨時(shí)檢查��。
3.對(duì)被市場(chǎng)監(jiān)督機(jī)構(gòu)發(fā)現(xiàn)的不合CE要求的產(chǎn)品���、或者使用過程中出現(xiàn)事故但是已加貼CE標(biāo)簽的產(chǎn)品���,必須采取補(bǔ)救措施。(比如從貨架上暫時(shí)拿 掉���,或從市場(chǎng)中永久地撤除)���。
4.已加貼 CE標(biāo)簽之產(chǎn)品型號(hào)在投放到歐洲市場(chǎng)后,若遇到歐盟有關(guān)的法律更改或變化��,其后續(xù)生產(chǎn)的同型號(hào)產(chǎn)品也必須相應(yīng)地加以更改或修正�����,以便符合歐盟新的法律要求�。

CE 認(rèn)證程序
1. 確認(rèn)出口國家
2. 確認(rèn)產(chǎn)品類別及歐盟相關(guān)產(chǎn)品指令
3. 指定“歐盟授權(quán)代表( 歐盟授權(quán)代理 ) ”(Authorized Representative)
4. 確認(rèn)認(rèn)證所需的模式(Module)
5. 采用 " 自我聲明 " 模式還是 " 必須通過第三方認(rèn)證機(jī)構(gòu)"
6. 建立技術(shù)文件 (Technical Files) 及其維護(hù)與更新
1、確認(rèn)出口國家
若出口至歐洲經(jīng)濟(jì)區(qū)EEA包括歐盟EU及歐洲自由貿(mào)易協(xié)議EFTA的 30 個(gè)成員國 中的任何一國����,則可能需要CE認(rèn)證。
2�����、確認(rèn)產(chǎn)品類別及歐盟相關(guān)產(chǎn)品指令
若產(chǎn)品屬于這里所列22 類中的任何一個(gè)��,一般地講,則需要進(jìn)行 CE認(rèn)證�。若一個(gè)產(chǎn)品同時(shí)屬于一個(gè)以上的類別,則必須滿足所有類別相對(duì)應(yīng)的產(chǎn)品指令中所列出的要求��。
注: 某些產(chǎn)品指令中有時(shí)會(huì)列出一些排除在指令外的產(chǎn)品����。
3、指定“歐盟授權(quán)代表( 歐盟授權(quán)代理 ) ”(Authorized Representative)
為了能確保前述CE標(biāo)志 (CE Marking )認(rèn)證實(shí)施過程中的4 項(xiàng)要求得以滿足�,歐盟法律要求位于30 個(gè) EEA 盟國境外的制造商 必須在歐盟境內(nèi)指定一家歐盟授 權(quán)代表 ( 歐盟授權(quán)代理 ) (AuthorizedRepresentative),以確保產(chǎn)品投放到歐洲 市場(chǎng)后��,在流通過程及使用期間產(chǎn)品“安全”的一貫性�;技術(shù)文件 (Technical Files)必須存放于歐盟境內(nèi)供監(jiān)督機(jī)構(gòu)隨時(shí)檢查;對(duì)被市場(chǎng)監(jiān)督機(jī)構(gòu)發(fā)現(xiàn)的不 合 CE要求的產(chǎn)品��、或者使用過程中出現(xiàn)事故但是已加貼CE標(biāo)簽的產(chǎn)品�,必須 采取補(bǔ)救措施。(比如從貨架上暫時(shí)拿掉����,或從市場(chǎng)中永久地撤除);已加貼 CE標(biāo)簽之產(chǎn)品型號(hào)在投放到歐洲市場(chǎng)后����,若遇到歐盟有關(guān)的法律更改或變化���,其后續(xù)生產(chǎn)的同型號(hào)產(chǎn)品也必須相應(yīng)地加以更改或修正��, 以便符合歐盟新的法律 要求��。
4���、確認(rèn)認(rèn)證所需的模式(Module)
對(duì)于幾乎所有的歐盟產(chǎn)品指令來說�,指令通常會(huì)給制造商提供出幾種 CE認(rèn)證 (Conformity Assessment Procedures)的模式 (Module) �����,制造商可根據(jù)本身的情況量體裁衣���,選擇最適合自已的模式�。一般地說�����,CE 認(rèn)證模式可分為以下9種基本模式 :
1.Module A: internal production control
模式 A: 內(nèi)部生產(chǎn)控制 ( 自我聲明 )
2.Module Aa: intervention of a Notified Body
模式 Aa: 內(nèi)部生產(chǎn)控制 加第 3 方檢測(cè)
3.Module B: EC type-examination
模式 B: EC型式試驗(yàn)
4.Module C: conformity to type
模式 C: 符合型式
5.Module D: production quality assurance
模式 D: 生產(chǎn)質(zhì)量保證
6.Module E: product quality assurance
模式 E: 產(chǎn)品質(zhì)量保證
7.Module F: product verification
模式 F: 產(chǎn)品驗(yàn)證
8.Module G: unit verification
模式 G: 單元驗(yàn)證
9.Module H: full quality assurance
模式 H: 全面質(zhì)量保證
基于以上幾種基本模式的不同組合��,又可能衍生出其它若干種不同的模式����。一 般地說���,并非任何一種模式均可適用于所有的產(chǎn)品。換言之���, 也并非制造商可以隨意選取以上任何一種模式來對(duì)其產(chǎn)品進(jìn)行CE認(rèn)證���。
5、采用“自我聲明”模式還是“必須通過第三方認(rèn)證機(jī)構(gòu)”
風(fēng)險(xiǎn)水平 (Risk Level) 較低 (Minimal Risk)
歐盟的產(chǎn)品指令允許某些類別中風(fēng)險(xiǎn)水平 (Risk Level) 較低 (Minimal Risk) 的產(chǎn)品之制造商選擇以模式A:“內(nèi)部生產(chǎn)控制 ( 自我聲明 ) ”的方式進(jìn)行CE 認(rèn)證��。
風(fēng)險(xiǎn)水平較高的產(chǎn)品必須通過第三方認(rèn)證機(jī)構(gòu) NB(Notified Body) 介入����。
對(duì)于風(fēng)險(xiǎn)水平較高的產(chǎn)品,其制造商必須選擇模式 A以外的其它模式����, 或者模式A外加其它模式來達(dá)到 CE 認(rèn)證。也就是說���,必須通過第三方認(rèn)證機(jī)構(gòu)NB(Notified Body)介入�����。
模式 A 以外的其它模式的認(rèn)證過程中�����,通常均需要至少一家歐盟認(rèn)可的認(rèn)證機(jī)構(gòu) NB 參于認(rèn)證過程中的一部分或全部��。根據(jù)不同的模式����,NB則可能分別以:來樣 檢測(cè)�����,抽樣檢測(cè)�����,工廠審查�,年檢,不同的質(zhì)量體系審核�����,等等方式介入認(rèn)證過 程,并出具相應(yīng)的 檢測(cè)報(bào)告���,證書等����。
目前��,已經(jīng)有 1200 多家認(rèn)證機(jī)構(gòu)獲得歐盟認(rèn)可��, 這些認(rèn)證機(jī)構(gòu)中的絕大多數(shù)位 于歐盟盟國境內(nèi)�。通常情況下, 一家 NB僅被歐盟授權(quán)可針對(duì)某一類或幾類產(chǎn)品 進(jìn)行某一或幾種模式下的認(rèn)證�����。換言之�����,一家歐盟授權(quán)的認(rèn)證機(jī)構(gòu)并不可能針 對(duì)所有的產(chǎn)品種類進(jìn)行認(rèn)證�,即使對(duì)其被授權(quán)的產(chǎn)品種類,通常情況下也并非 被授權(quán)所有的模式�����。對(duì)于每一個(gè)歐盟的產(chǎn)品指令,通常都有一個(gè)針對(duì)該產(chǎn)品指 令的授權(quán)認(rèn)證機(jī)構(gòu)NB名錄�����。
6���、建立技術(shù)文件 (Technical Files)及其維護(hù)與更新
歐盟法律要求����,加貼了 CE標(biāo)簽的產(chǎn)品投放到歐洲市場(chǎng)后�����, 其技術(shù)文件 (TechnicalFiles) 必須存放于歐盟境內(nèi)供監(jiān)督機(jī)構(gòu)隨時(shí)檢查�����。技術(shù)文件中所包涵的內(nèi)容若有變化���,技術(shù)文件也應(yīng)及時(shí)地更新。
"技術(shù)文檔"是歐盟醫(yī)療器械指令中很重要的一個(gè)事項(xiàng)���, 它的目的是要求企 業(yè)準(zhǔn)備充份的技術(shù)資料和證明�, 供主管機(jī)關(guān)抽查, 或發(fā)生訴訟糾紛時(shí)使用��。 各歐盟指令對(duì)于 " 技術(shù)檔案 " 的要求有所差別�, 在這里謹(jǐn)以中國出口企業(yè)最 常用的“醫(yī)療器械”的要求為例,加以說明�����。
醫(yī)療器械指令 93/42/ EEC要求 " 技術(shù)檔案 " 可能包含下列項(xiàng)目:
A��、企業(yè)的質(zhì)量手冊(cè)和程序文件
B���、企業(yè)簡(jiǎn)介及歐洲代理名稱�、聯(lián)系方式
C����、CE符合性聲明(或稱自我保證聲明, 若該產(chǎn)品是和其它設(shè)備聯(lián)合運(yùn)用����, 則應(yīng)有整體符合基本要求的證明材料)
1.產(chǎn)品名稱、分類及引用標(biāo)準(zhǔn)條款的簡(jiǎn)要描述
2.產(chǎn)品概述(包括類型和預(yù)期用途)
a) 產(chǎn)品的歷史沿革
b) 技術(shù)性能參數(shù)
c) 產(chǎn)品配合使用的附件�、配合件和其它設(shè)備清單
d) 產(chǎn)品的圖示與樣品
e) 產(chǎn)品所用原材料及供應(yīng)商
3.使用該產(chǎn)品的調(diào)和標(biāo)準(zhǔn) / 或其它標(biāo)準(zhǔn)
4.風(fēng)險(xiǎn)分析評(píng)估結(jié)論和預(yù)防措施( EN1441 產(chǎn)品服務(wù)危險(xiǎn)分析報(bào)告)
5.生產(chǎn)質(zhì)量控制
a) 產(chǎn)品資料和控制文檔(包括產(chǎn)品生產(chǎn)工藝流程圖)
b) 產(chǎn)品的滅菌方法和確認(rèn)的描述
c) 滅菌驗(yàn)證
d) 產(chǎn)品質(zhì)量控制措施
e) 產(chǎn)品穩(wěn)定性和效期的描述
6.包裝和標(biāo)識(shí)
a) 包裝材料說明
b) 標(biāo)簽
c) 使用說明書
7.技術(shù)評(píng)價(jià)
a) 產(chǎn)品檢驗(yàn)報(bào)告及相關(guān)文獻(xiàn)
b) 技術(shù)概要及權(quán)威觀點(diǎn)
8.潛在風(fēng)險(xiǎn)評(píng)價(jià)
a) 產(chǎn)品潛在風(fēng)險(xiǎn)測(cè)試報(bào)告及相關(guān)文獻(xiàn)
b) 潛在風(fēng)險(xiǎn)的概要及權(quán)威觀點(diǎn)
9.臨床評(píng)價(jià)
a) 產(chǎn)品臨床測(cè)試報(bào)告及相關(guān)文獻(xiàn)
b) 臨床使用概述及權(quán)威觀點(diǎn)
附錄 1、產(chǎn)品出廠檢測(cè)報(bào)告
附錄 2��、產(chǎn)品型式檢測(cè)報(bào)告
附錄 3、基本要求檢查表
注:
1����、臨床研究(包括:物理性能,生化��、藥理 �、藥動(dòng)及毒性研究,功 效測(cè)試�����,滅菌合格證明���,藥物相容性等)
2、生物兼容性測(cè)試
( A)EN30993 第一部分要求:細(xì)胞毒性����、感光性、刺激 - 皮內(nèi)反應(yīng)���、急性 全身中毒�����、致熱性���、亞急性中毒����、遺傳毒性�、植入溶血性;
( B)支持測(cè)試:慢性中毒��、致癌性����、再生性 / 生長性毒素、生物動(dòng)因退化���。)
3����、臨床資料(需要臨床研究或描述臨床研究)
4�、包裝合格證明(EN868)
5、標(biāo)簽��、使用說明(EN980����、EN1041)
6�、結(jié)論(設(shè)計(jì)檔案資料的接受�����、利益對(duì)應(yīng)風(fēng)險(xiǎn)的陳述)
上述文件都必須用歐盟官方語言之一 ( 英��、德���、法文 ) 編寫����,但使用說明必須用使用者所在國語言編寫��。所有文件應(yīng)在最后一次出貨后����,至少保存五年���。
體外診斷醫(yī)療器械 IVDD產(chǎn)品分類
根據(jù) 98/79/EC( IVDD)指令附錄2 確定產(chǎn)品分類原則對(duì)有認(rèn)證需求的產(chǎn)品進(jìn)行分類��。分類的依據(jù)是產(chǎn)品所診斷的疾病���。常見產(chǎn)品的分類可參考下表:

與上述診斷試劑配套使用的校準(zhǔn)品����、儀器���、標(biāo)本采集保存用具均屬于體外診斷器 械指令管理的范疇�����。
醫(yī)療器械 MDD產(chǎn)品分類
CE認(rèn)證過程中判斷一個(gè)醫(yī)療器械正確的分類�����,僅憑器械的名稱是不夠的�,必須知道完整的預(yù)期使用目的(Intended Purpose)!
我們經(jīng)常聽到這樣的一句話問題: 某某產(chǎn)品在 CE分類里屬于幾類醫(yī)療器械��? 提問者也許不知道僅從一個(gè)醫(yī)療器械的名稱而判斷其 CE認(rèn)證過程中的分類經(jīng) 常是不妥當(dāng)?shù)模?/span>
1���、歐盟與美國的區(qū)別 歐盟與美國的醫(yī)療器械的分類有很大的不同��。
美國的 FDA將醫(yī)療器械根據(jù)其通用的特點(diǎn) 事先已經(jīng)分類 并建立了一個(gè)公開的數(shù)據(jù)庫可查詢���;
歐盟則是建立了一套分類規(guī)則���,讓制造商根據(jù)產(chǎn)品的預(yù)期使用目的(Intended Purpose)按照分類規(guī)則自己進(jìn)行分類。
2�����、同一個(gè)產(chǎn)品����,既可以是醫(yī)療器械,也可以不是醫(yī)療器械
在美國���,一個(gè)產(chǎn)品是否為醫(yī)療器械完全由 FDA決定���;
在歐盟,一個(gè)產(chǎn)品是否為醫(yī)療器械由制造商 ( 申明的產(chǎn)品預(yù)期使用目的) 決定 , 比如:電熱褥既可以是醫(yī)療器械����,也可以不是醫(yī)療器械。
3�����、同一個(gè)產(chǎn)品�����,可以是不同類別的醫(yī)療器械
比如: 制造商申明的預(yù)期使用目的不同����, 電熱褥既可以是 I 類醫(yī)療器械, 也可以是 IIa 或 IIb類醫(yī)療器械���。
4�����、同一個(gè)產(chǎn)品�����,作為系統(tǒng)的一部分時(shí)與作為配件時(shí)屬于不同的類別
比如:手術(shù)過程中用非主動(dòng)式抽取腹水裝置的留在體外的盛腹水的容器��, 作為系統(tǒng)的一部分時(shí)可屬于IIa 類���,但是作為配件時(shí)則可屬于I 類。
5��、類似的產(chǎn)品,可以是不同類別的醫(yī)療器械
比如: X光拍片時(shí)常用的圖像儲(chǔ)存通信系統(tǒng)Picture Archiving and Communication Systems (PACS) �,不同制造商申明的預(yù)期使用目 ( 功能) 的不同, PACS可以是 I 類醫(yī)療器械���,也可以是IIa 或 IIb 類醫(yī)療器械����。
6���、類似的產(chǎn)品����,有的屬于醫(yī)療器械 MD, 有的則屬于體外診斷器械 IVD
比如:采血管如果 是侵入式的或接觸到皮膚的����,則屬于 MDD 93/42/EEC指令管轄的(普通)醫(yī)療器械 MD;
如果 是非侵入式的或完全接觸不到皮膚的����,則屬于IVD 98/79/ec 指令管轄的體外診斷器械IVD。
醫(yī)療器械指令 MDD 93/42/eec附錄九中詳定18 條規(guī)則����,按醫(yī)療產(chǎn)品的危險(xiǎn)程度����,將產(chǎn)品分為Ⅰ類���、Ⅱa類、Ⅱb類���、Ⅲ類�。
產(chǎn)品分類規(guī)則:
1��、規(guī)則應(yīng)用由器械的預(yù)期使用目的決定�;
2、如果器械是和其它器械配合使用����,分類規(guī)則分別適用于每種器械;
3����、附件可以和其它一起使用的器械分開單獨(dú)分類;
4����、啟動(dòng)或影響某種器械的軟件與器械屬于同一類型�。
分類準(zhǔn)則:
時(shí)間:暫時(shí)(<60 分鐘)���、短期(<30 天)����、長期( >30 天)
創(chuàng)傷性:非創(chuàng)傷���、通過孔徑創(chuàng)傷����,外科創(chuàng)傷 ����、植入。
適用位置:中央循環(huán)���、中樞神經(jīng)系統(tǒng)��,其它地方����。
能量供應(yīng):無源��,有源。
規(guī)則 1~4��、所有非創(chuàng)傷性器械均屬于I 類�����,除非他們:
用于儲(chǔ)存體液 ( 血袋例外) II a 類
于 Ila類或更高類型的有源醫(yī)療器械類II a 類
改變體液成分 II a / II b 類
一些傷口敷料 II a / II b 類
規(guī)則 5�、侵入人體孔徑的醫(yī)療器械
暫時(shí)使用(牙科壓縮材料��、檢查手套 ) I類
短期使用(導(dǎo)管��、隱形眼鏡)II a類長期使用(正常牙線) II b類
規(guī)則 6-8 ����、外科創(chuàng)傷性器械
再使用的外科器械(鉗子,斧子) I類
暫時(shí)或短期使用(縫合針��。外科手套) 11a類
長期使用(假關(guān)節(jié)���,眼內(nèi)晶體 )II b 類
與中央循環(huán)系統(tǒng) (CCS)或中樞神經(jīng)系統(tǒng)接觸的器械 III 類
規(guī)則 9�����、給予或交換能量的治療器械 II a 類
(肌肉刺激器��、電鉆����、皮膚光療機(jī)、助聽器)
一種潛在危險(xiǎn)方式工作的II b 類
(嬰兒培養(yǎng)箱�����、高頻電刀�����、超聲碎石機(jī)��、 X 光機(jī))
規(guī)則 10���、診斷器械
提供能量( 核磁共振����,超聲診斷儀)IIa 類
診斷/監(jiān)視體內(nèi)放射藥物分布 II a 類
(r照相機(jī)�、正電子發(fā)射成像儀)
診斷/監(jiān)視生理功能(心電圖、腦電圖) II a 類
危險(xiǎn)情況下監(jiān)視生理功能II b 類
(手術(shù)中的血?dú)夥治鰞x)
發(fā)出電離輻射 (X 射線診斷議) II b 類
規(guī)則 11 控制藥物或其他物質(zhì)進(jìn)出人體的有源器械 II a 類
(吸引設(shè)備��、供給泵)
如以一種潛在危險(xiǎn)方式工作 II b 類
(麻醉機(jī)����、呼吸機(jī)���、透析機(jī)、高壓氧艙)
規(guī)則 12 所有其他有源醫(yī)療器械屬于I 類
(觀察燈���、牙科椅�����、輪椅、牙科用治療燈��、記錄處理觀察診斷圖象用的 有源器械)
規(guī)則 13���、與醫(yī)用物質(zhì)結(jié)合的器械(含殺精子的避孕套����、含抗生素的牙髓材料)III類
規(guī)則 14�����、避孕用具(避孕套���、子宮帽II b 類 ) II b/III 類 (子宮內(nèi)避孕器III 類)
規(guī)則 15���、清洗或消毒的器械
醫(yī)療器械 ( 內(nèi)窺鏡消毒 ) II a 類
接觸鏡 ( 消毒液��、護(hù)理液 ) II a 類
規(guī)則 16����、用于記錄X射線圖象的器械 (X 光片 ) II a 類
規(guī)則 17�、利用動(dòng)物組織的器械(生物)心臟瓣膜、腸線����、膠原) III 類
規(guī)則 18、血袋 II b 類
各種類型醫(yī)療器械的 CE認(rèn)證步驟
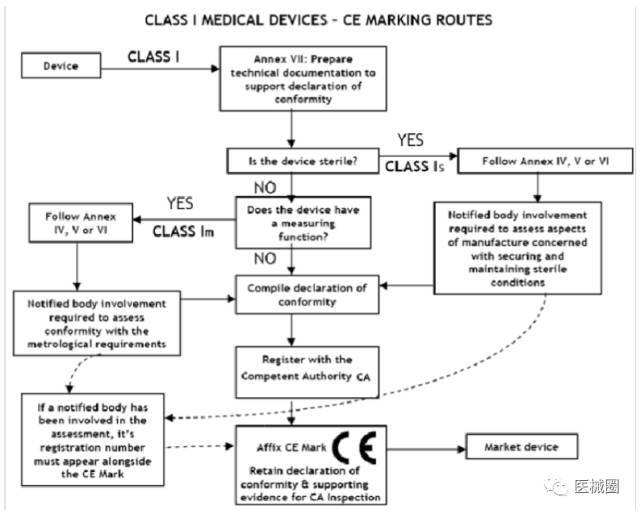
I 類醫(yī)療器械的 CE認(rèn)證步驟
1��、分類:確認(rèn)產(chǎn)品屬于I 類醫(yī)療器械
2�����、選擇符合性評(píng)估途徑:請(qǐng)參考下面的流程圖
3��、編制技術(shù)文件
4����、CE符合性聲明
5���、委任歐盟授權(quán)代表
6、由歐盟授權(quán)代表將制造商及產(chǎn)品在歐盟主管機(jī)關(guān)注冊(cè)
7����、建立售后警戒系統(tǒng)/ 加貼 CE標(biāo)簽并將產(chǎn)品投放市場(chǎng)
I類醫(yī)療器械: CE 符合性評(píng)估途徑
1、制造商有責(zé)任確保其產(chǎn)品符合93/42/eec指令的所有相關(guān)的基本要求��,必須制定一 份書面(自我)聲明來保證�����。
2���、不具備測(cè)量功能或非滅菌的 I 類醫(yī)療器械(的 CE認(rèn)證過程中)不需要第三方公告機(jī) 構(gòu)(NB) 參與。 是否符合ISO13485:2003標(biāo)準(zhǔn)�,由制造商自愿選擇,并非強(qiáng)制性�。
3、具有測(cè)量功能或滅菌類的 I 類醫(yī)療器械(的 CE認(rèn)證過程中)必須要有第三方公告機(jī) 構(gòu)(NB) 參與��。
4��、一旦制造商認(rèn)為其產(chǎn)品符合 93/42/eec 指令的所有相關(guān)的基本要求,(歐盟境內(nèi)的) 制造商�����,或者(歐盟境外制造商的)歐盟授權(quán)代表必須先在歐盟主管機(jī)關(guān)注冊(cè)�����, 然 后才可 加貼 CE標(biāo)簽并將產(chǎn)品投放EEA市場(chǎng)���。
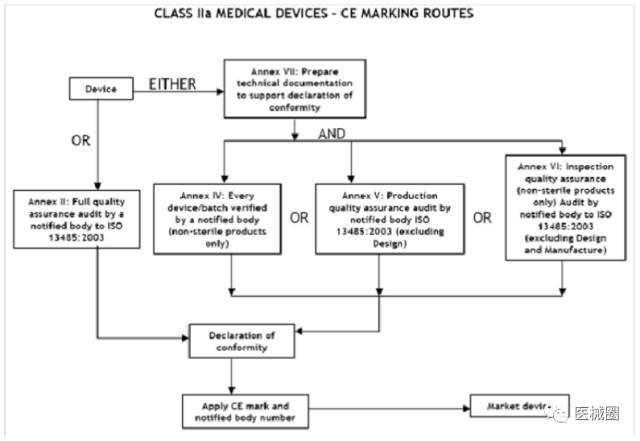
IIa類醫(yī)療器械的CE認(rèn)證步驟
1���、分類:確認(rèn)產(chǎn)品屬于IIa類醫(yī)療器械
2、選擇符合性評(píng)估途徑:請(qǐng)參考下面的流程圖
3�、編制技術(shù)文件
4、委任歐盟授權(quán)代表
5���、從第三方公告機(jī)構(gòu)(NB) 獲得 CE證書
6����、( 完成 )CE 符合性聲明
7�����、將技術(shù)文件存放在歐盟授權(quán)代表處( 供歐盟主管機(jī)關(guān)隨時(shí)檢查 )
8、建立 ( 售后 ) 警戒系統(tǒng)/ 加貼CE標(biāo)簽并將產(chǎn)品投放 EEA市場(chǎng)
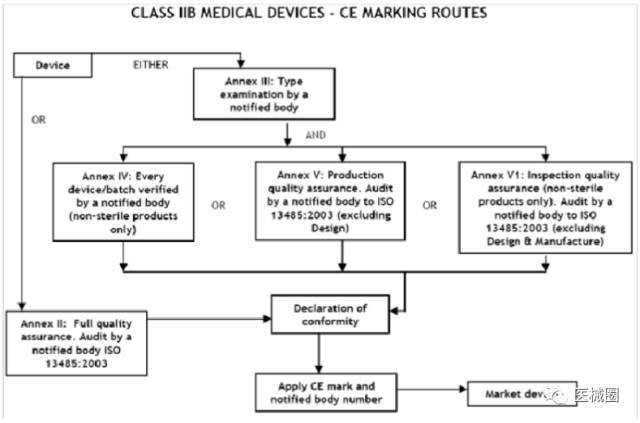
IIb類醫(yī)療器械的CE認(rèn)證步驟
1����、分類:確認(rèn)產(chǎn)品屬于IIb 類醫(yī)療器械
2、選擇符合性評(píng)估途徑:請(qǐng)參考下面的流程圖
3��、編制技術(shù)文件
4���、委任歐盟授權(quán)代表
5���、從第三方公告機(jī)構(gòu)(NB) 獲得 CE證書
6、( 完成 )CE 符合性聲明
7��、將技術(shù)文件存放在歐盟授權(quán)代表處( 供歐盟主管機(jī)關(guān)隨時(shí)檢查 )
8����、建立 ( 售后 ) 警戒系統(tǒng) / 加貼CE標(biāo)簽并將產(chǎn)品投放EEA市場(chǎng)
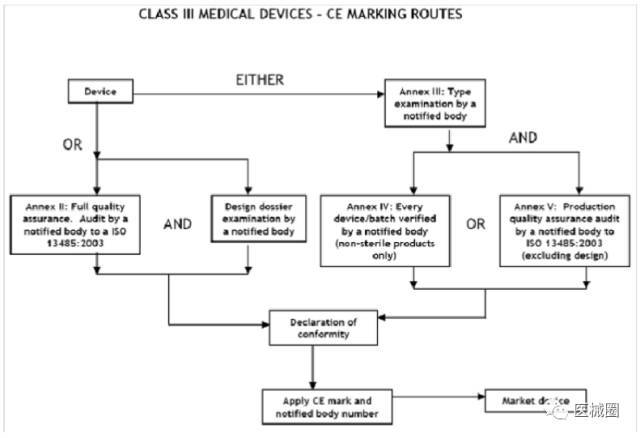
III類醫(yī)療器械的CE認(rèn)證步驟
1、分類:確認(rèn)產(chǎn)品屬于III類醫(yī)療器械
2��、選擇符合性評(píng)估途徑:請(qǐng)參考下面的流程圖
3�����、編制技術(shù)文件
4�����、委任歐盟授權(quán)代表
5�����、從第三方公告機(jī)構(gòu)(NB) 獲得 CE證書
6����、( 完成 )CE 符合性聲明
7、將技術(shù)文件存放在歐盟授權(quán)代表處( 供歐盟主管機(jī)關(guān)隨時(shí)檢查 )
8�����、建立 ( 售后 ) 警戒系統(tǒng) / 加貼CE標(biāo)簽并將產(chǎn)品投放EEA市場(chǎng)