定制式義齒注冊產(chǎn)品是齒科器械中的明星產(chǎn)品之一�,在臨床上廣泛使用。定制式義齒在我國屬于第二類醫(yī)療器械注冊產(chǎn)品���,需要通過醫(yī)療器械注冊技術審評和醫(yī)療器械注冊質(zhì)量管理體系核查方可取得醫(yī)療器械注冊證���。本文為大家?guī)砩虾J?023年度定制式義齒現(xiàn)場檢查問題匯總及分析,一起來學習����。
定制式義齒注冊產(chǎn)品是齒科器械中的明星產(chǎn)品之一����,在臨床上廣泛使用�����。定制式義齒在我國屬于第二類醫(yī)療器械注冊產(chǎn)品�����,需要通過醫(yī)療器械注冊技術審評和醫(yī)療器械注冊質(zhì)量管理體系核查方可取得醫(yī)療器械注冊證�����。本文為大家?guī)砩虾J?023年度定制式義齒現(xiàn)場檢查問題匯總及分析���,一起來學習�����。
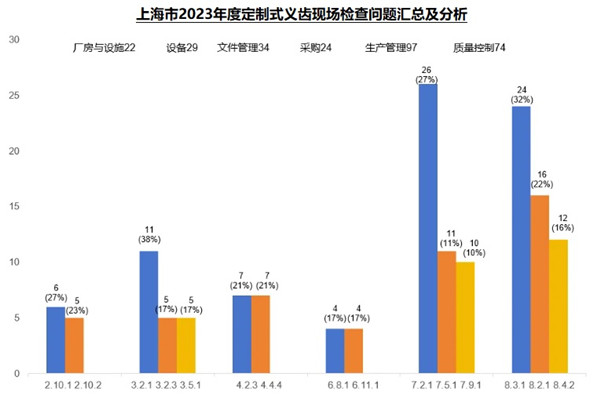
上海市2023年度定制式義齒現(xiàn)場檢查問題匯總及分析
1�、年度檢查概況
2023年度���,本市定制式義齒現(xiàn)場核查合計發(fā)現(xiàn)缺陷409項���。廠房與設施(22項次)���、設備(29項次)��、文件管理(34項次)��、采購(24項次)����、生產(chǎn)管理(97項次)、質(zhì)量控制(74項次)占比超八成���,下面將對這六個方面的關鍵風險點及常見核查問題進行梳理分析����。
2���、現(xiàn)場核查常見問題
下面將從廠房和人員��、設備����、文件管理、采購����、生產(chǎn)管理、質(zhì)量控制四個方面對無菌醫(yī)療器械的常見核查問題進行梳理分析�。
2.1 廠房和人員
2.10.1 倉儲區(qū)應當能夠滿足原材料、包裝材料��、中間品�、產(chǎn)品等儲存條件和要求。
原料存儲溫度和要求不一致��;未提供溫濕度控制要求�;未制定已領用原材料使用后結(jié)存物料的管控要求。
2.10.2 倉儲區(qū)應當按照待驗���、合格��、不合格����、退貨或召回等驚醒有序����、分區(qū)存放各類材料和產(chǎn)品�����,便于檢查和監(jiān)控��。
缺少物料標簽��,領用記錄;物料放置的區(qū)域不合理����,例如不合格品區(qū)放置部分暫存品。
2.2 設備
3.2.1 生產(chǎn)設備的設計��、選型�����、安裝�����、維修和維護應當符合預定用途�����,便于操作、清潔和維護�。
未提供設備驗證報告或未完成。
3.2.2 生產(chǎn)設備應當有明顯的狀態(tài)標識��,預防非預期使用��。
生產(chǎn)設備無狀態(tài)標識����;企業(yè)未建立相關的管理制度。
3.2.3 應當建立主要生產(chǎn)設備使用����、清潔、維護和維修的操作規(guī)程���,并保存相應的設備操作記錄���。
設備無編號,無操作規(guī)程��,無保養(yǎng)規(guī)程��。
3.5.1 計量器具的量程精度應當滿足使用要求,計量器具應當標明其校準的有效期��,保存相應記錄����。
計量器具未進行校準或無法提供校準證書,例如溫度計未進行校準���。
2.3 文件管理
4.2.3 文件更新或者修訂式應當按照規(guī)定評審和批準 ����,能夠識別文件的更改和修訂狀態(tài)��。
1)文件內(nèi)容不一致��,例如《消毒作業(yè)指導書》規(guī)定口腔石膏模型為紫外線臭氧消毒30分鐘���,現(xiàn)場查見《作業(yè)環(huán)境和產(chǎn)品清潔、消毒規(guī)定》中���,消毒45分鐘���。
2)無法識別文件的更改或修訂狀態(tài)�����,例如作業(yè)文件未見文件標題����,版本號�,批準時間等信息;未能提供文件修訂相應的批準審核記錄����。
4.2.4 分發(fā)和使用的文件應當為適宜文本,已撤銷或作廢的文件應當進行標識���,防止誤用�����。
技術文件上沒有受控章����;同一版文件內(nèi)容不同�����。
4.3.1 應當確認作廢的技術文件等必要的質(zhì)量管理體系文件的保存期限,滿足產(chǎn)品維修和產(chǎn)品質(zhì)量責任追溯等需要����。
未規(guī)定作廢的質(zhì)量管理體系文件的保存期限。
4.4.1 應當建立記錄控制程序��,包括記錄的 標識�、保管、檢索�、保存期限和處置要求等。
企業(yè)現(xiàn)采用某義齒軟件系統(tǒng)進行生產(chǎn)�����、檢驗過程的記錄管理��,未制定電子記錄的管控要求���。
4.4.4 記錄不得隨意涂改或銷毀,更改記錄應當簽注姓名和日期��,并使原有信息仍清洗可辨�,必要時,應當說明更改理由��。
生產(chǎn)記錄存在涂改情況且無簽名;培訓日期隨意涂改且無涂改人員簽字�。
2.4 采購
6.2.1 生產(chǎn)按照第二類醫(yī)療器械注冊的定制式義齒,應當采購經(jīng)食品藥品監(jiān)督管理部門批準注冊或備案的義齒原材料���,其技術指標應當符合強制性標準或經(jīng)注冊或備案的產(chǎn)品技術要求���。
采購控制程序中未包含供應商再評價要求;現(xiàn)場未能提供原材料清單�����。
6.5.1 應當根據(jù)采購物品對產(chǎn)品的影響����,確定對采購物品實行控制的方式和程度。
原材料清單未查見活動義齒所用原材料信息����;未對采購物品進行分級分類管理。
6.7.1 應當與主要原材料商簽訂質(zhì)量協(xié)議�����,明確雙方所承擔的質(zhì)量責任。
質(zhì)量協(xié)議中未明確采購產(chǎn)品的注冊信息及要求���;未與主要原材料供方簽訂質(zhì)量協(xié)議�。
6.8.1 采購時應當明確采購信息����,清晰表述采購要求,包括采購物品類別����、驗收準則,規(guī)格型號��,規(guī)程��、圖樣等內(nèi)容����。
質(zhì)量協(xié)議或采購合同中未明確原料采購信息,如生產(chǎn)廠商和注冊證號��;質(zhì)量協(xié)議中未明確物料名稱�����、規(guī)格型號����、技術指標等。
6.11.1 應當制定口腔印模�����,口腔模型����,口腔掃描數(shù)據(jù)及設計單的接受準測。
企業(yè)未制定口腔掃描數(shù)據(jù)的接收準則�����;口腔掃描數(shù)據(jù)未賦批號����,僅有患者姓名,與其內(nèi)部批號管理要求不一致����。
2.5 生產(chǎn)管理
7.2.1 應當編制生產(chǎn)工藝規(guī)程,作業(yè)指導書等�,明確關鍵工序和特殊過程���。
1)生產(chǎn)作業(yè)指導書關鍵數(shù)據(jù)缺失或者過于簡單,無法指導實際生產(chǎn)�,例如關鍵工序為氧化鋯燒結(jié),僅規(guī)定了氧化鋯結(jié)晶的最高溫度及時間���,未對結(jié)晶過程中的升溫速率���、保溫時間等參數(shù)作出規(guī)定。
2)生產(chǎn)方式為增材制造的企業(yè)����,較為突出的共性問題是金屬粉末方面的,例如未明確鈦合金粉末的打印過程中新舊粉末添加比例��、次數(shù)要求����。
3)實際生產(chǎn)條件與技術文件規(guī)定不一致,例如金屬打印室的溫濕度與《車間溫濕度管理制度》要求不一致�����。
4)未明確活動義齒關鍵工藝�、特殊過程���。
7.3.1 應當明確口腔印模�����,口腔模型及成品的消毒方法�,并按照要求進行消毒。
實際消毒方案與消毒作業(yè)指導書不一致�。
7.5.1 生產(chǎn)過程中采用的計算機軟件對產(chǎn)品質(zhì)量有影響的,應當進行驗證和確認�����。
軟件驗證報告測評人不會操作軟件�;未提供軟件驗證方案或驗證記錄。
7.9.1 每個產(chǎn)品應當有生產(chǎn)記錄����,并滿足追溯要求。
生產(chǎn)過程中時間邏輯錯誤�,例如生產(chǎn)檢驗時間晚于生產(chǎn)記錄的批準審核時間;原材料的采購時間晚于生產(chǎn)驗證時間��。
7.9.2 生產(chǎn)記錄應當包括所用的主要義齒原材料生產(chǎn)企業(yè)名稱�����、主要義齒原材料名稱產(chǎn)品名稱,金屬品牌型號�、批號/編號、主要生產(chǎn)設備名稱或編號�����、操作人員等內(nèi)容����。
生產(chǎn)記錄記錄缺失是或者不完整,例如無生產(chǎn)設備編號��;未提供物料平衡核查記錄��。
2.6 質(zhì)量控制
8.2.1 應當定期對檢驗儀器和設備進行校準或者檢定����,并予以標識。
儀器校準范圍未包含該儀器的全部檢測范圍�����,常見的設備有數(shù)顯卡尺�,測厚儀����。
8.3.1 應當根據(jù)強制性標準以及經(jīng)注冊或者備案的產(chǎn)品技術要求制定產(chǎn)品的檢驗規(guī)程���,并出具相應的檢驗報告或證書。
1)檢驗作業(yè)指導書內(nèi)容存在漏洞�,例如定制式活動義齒成品檢驗規(guī)程未明確激光熔鑄義齒表面粗糙度、尺寸等項目的檢驗規(guī)則���。
2)檢驗機構承檢資質(zhì)存在問題���,例如生產(chǎn)廠家無法提供檢測機構的資質(zhì)證明。
8.4.2 檢驗要求應當不低于強制性標準要求和國家有關產(chǎn)品的相關規(guī)定�。
實際檢驗方式與檢驗作業(yè)指導書不一致,例如檢驗規(guī)程規(guī)定產(chǎn)品衛(wèi)生指標為初始污染菌≤200cfu/g�,產(chǎn)品技術要求中規(guī)定≤20cfu/g。
3���、總結(jié)建議
綜合來看�����,定制式義齒現(xiàn)場檢查的共性問題主要集中在廠房與設施�、設備、文件管理��、采購�、生產(chǎn)管理,質(zhì)量控制等方面��。其中增材制造企業(yè)金屬粉末的管理問題較為突出���,在應用增材制造新技術的同時�,生產(chǎn)企業(yè)和監(jiān)管部門應當關注金屬粉末的管理等問題����,保障公眾用械安全。
如有定制式義齒注冊咨詢�����,或是其他上海市第二類醫(yī)療器械注冊咨詢服務需求����,歡迎您隨時方便與杭州證標客醫(yī)藥技術咨詢有限公司聯(lián)絡,聯(lián)系人:葉工�,電話:18058734169,微信同。