醫(yī)療器械獨(dú)立軟件注冊產(chǎn)品越來越多的出現(xiàn)在臨床應(yīng)用中,關(guān)于獨(dú)立軟件注冊產(chǎn)品的質(zhì)量管理體系����,盡管國家局已發(fā)布GMP規(guī)范獨(dú)立軟件附錄,但仍然是多數(shù)企業(yè)薄弱環(huán)節(jié)�。本文為大家?guī)砩虾at(yī)療器械獨(dú)立軟件注冊產(chǎn)品現(xiàn)場核查常見問題分析,無論是上海醫(yī)療器械生產(chǎn)企業(yè)���,還是其它地區(qū)醫(yī)用軟件生產(chǎn)企業(yè)����,均可以參考本文��,更好的規(guī)劃軟件設(shè)計(jì)開發(fā)�����、生產(chǎn)和質(zhì)量保證活動��。
醫(yī)療器械獨(dú)立軟件注冊產(chǎn)品越來越多的出現(xiàn)在臨床應(yīng)用中�,關(guān)于獨(dú)立軟件注冊產(chǎn)品的質(zhì)量管理體系,盡管國家局已發(fā)布GMP規(guī)范獨(dú)立軟件附錄�����,但仍然是多數(shù)企業(yè)薄弱環(huán)節(jié)�。本文為大家?guī)砩虾at(yī)療器械獨(dú)立軟件注冊產(chǎn)品現(xiàn)場核查常見問題分析,無論是上海醫(yī)療器械生產(chǎn)企業(yè)����,還是其它地區(qū)醫(yī)用軟件生產(chǎn)企業(yè),均可以參考本文�,更好的規(guī)劃軟件設(shè)計(jì)開發(fā)、生產(chǎn)和質(zhì)量保證活動�����。
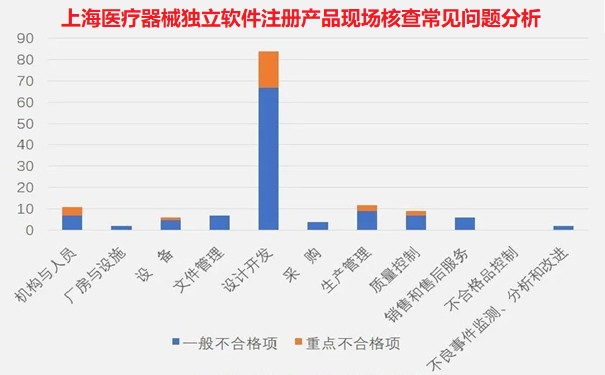
上海醫(yī)療器械獨(dú)立軟件注冊產(chǎn)品現(xiàn)場核查常見問題分析
一、上海醫(yī)療器械獨(dú)立軟件注冊企業(yè)現(xiàn)場檢查情況
2022年度上海器審中心依據(jù)《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》(以下簡稱規(guī)范)和《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范附錄獨(dú)立軟件》(以下簡稱軟件附錄)對本市醫(yī)療器械軟件生產(chǎn)企業(yè)開展現(xiàn)場體系核查���,包括注冊質(zhì)量管理體系核查和生產(chǎn)許可現(xiàn)場體系核查�����。核查產(chǎn)品涉及醫(yī)學(xué)圖像處理���、體外診斷、醫(yī)學(xué)數(shù)據(jù)處理等種類��。2022年度獨(dú)立軟件現(xiàn)場核查共發(fā)現(xiàn)不符合項(xiàng)143項(xiàng)���,其中關(guān)鍵項(xiàng)27項(xiàng)����,一般項(xiàng)116項(xiàng)�。單次檢查發(fā)現(xiàn)不符合項(xiàng)最多為14項(xiàng),最少為1項(xiàng)���,其中關(guān)鍵項(xiàng)最多為5項(xiàng)��,最少為0項(xiàng)��。
二����、上海醫(yī)療器械獨(dú)立軟件注冊企業(yè)現(xiàn)場檢查不符合項(xiàng)分布情況
從規(guī)范獨(dú)立軟件附錄各章節(jié)不符合項(xiàng)分布情況(見圖一)來看���,設(shè)計(jì)開發(fā)占比最多�,不合格品控制無不合格項(xiàng)���。占前五位的分別為設(shè)計(jì)開發(fā)(59%)����、生產(chǎn)管理(8%)��、機(jī)構(gòu)與人員(8%)����、質(zhì)量管理(6%)和文件與記錄(5%)。
三����、上海醫(yī)療器械獨(dú)立軟件注冊企業(yè)現(xiàn)場核查常見問題
通過分析上述不合格項(xiàng)的數(shù)據(jù),主要存在以下方面問題:
(1)軟件需求內(nèi)容較為簡單�,未覆蓋獨(dú)立軟件產(chǎn)品部分已實(shí)現(xiàn)功能��,需求規(guī)格書中缺乏對交互界面�、性能���、風(fēng)險(xiǎn)分析以及標(biāo)準(zhǔn)要求等相關(guān)內(nèi)容描述�。軟件設(shè)計(jì)未根據(jù)軟件需求實(shí)施系統(tǒng)設(shè)計(jì)���,設(shè)計(jì)要求不明確或有遺漏����,詳細(xì)設(shè)計(jì)不充分�����。部分企業(yè)對于軟件可追溯性分析要求認(rèn)識不充分����,未有效實(shí)施貫穿軟件需求、軟件設(shè)計(jì)����、軟件測試、軟件風(fēng)險(xiǎn)等相關(guān)的軟件可追溯性分析。
(2)軟件測試用例過于簡單���,未覆蓋風(fēng)險(xiǎn)項(xiàng)����,可操作性差���,測試數(shù)據(jù)不明確或使用不規(guī)范,導(dǎo)致軟件驗(yàn)證不充分��。軟件測試(含單元����、集成以及系統(tǒng)測試)未依據(jù)相應(yīng)測試計(jì)劃實(shí)施,未形成相應(yīng)軟件測試報(bào)告以及評審記錄����,并未適時(shí)更新。
(3)軟件缺陷管理缺乏缺陷分析評估�����、軟件缺陷修復(fù)�、回歸測試、風(fēng)險(xiǎn)管理、配置管理��、評審等活動的相關(guān)要求及記錄��。
(4)未充分識別現(xiàn)成軟件��,現(xiàn)成軟件使用也未按要求形成文件和記錄�。軟件配置管理要求不明確,配置管理記錄缺失或不完整����。軟件版本變更未按軟件版本命名規(guī)則的進(jìn)行管理變更。
(5)部分企業(yè)仍存在測試人員與開發(fā)人員職責(zé)不清��、同一項(xiàng)目開發(fā)人員既編碼又承擔(dān)黑盒測試的情況����。
(6)獨(dú)立軟件交付物的生產(chǎn)及檢驗(yàn)要求不明確,相關(guān)記錄缺失或不完整����。
四、上海市藥監(jiān)局對上海醫(yī)療器械獨(dú)立軟件生產(chǎn)企業(yè)的建議
獨(dú)立軟件具有特殊性����,由于需求不明確,風(fēng)險(xiǎn)分析不充分,測試不充分����,會引發(fā)軟件頻繁變更,可能導(dǎo)致在產(chǎn)品上市后引起嚴(yán)重后果����。通過對2022年現(xiàn)場檢查不合格項(xiàng)分析,對于機(jī)構(gòu)與人員���、設(shè)計(jì)開發(fā)��、生產(chǎn)管理和質(zhì)量控制等主要環(huán)節(jié),提出以下建議:
(1)軟件開發(fā)過程中須明確規(guī)定軟件開發(fā)人員與測試人員的職責(zé)��,避免同一軟件項(xiàng)開發(fā)與黑盒測試由一人實(shí)施的情況���。(2)應(yīng)當(dāng)基于軟件生存周期過程控制要求嚴(yán)格實(shí)施軟件需求分析��、設(shè)計(jì)����、驗(yàn)證及確認(rèn)等主要軟件開發(fā)活動���,加強(qiáng)軟件質(zhì)量意識�,提高軟件測試用例質(zhì)量和測試能力。同時(shí)�����,加強(qiáng)對軟件配置管理���、現(xiàn)成軟件使用����、缺陷管理和軟件版本管理等活動的控制����。
(3)在生產(chǎn)管理方面,應(yīng)當(dāng)確保軟件發(fā)布的一致性����、可重復(fù)性;不同交付方式(物理交付��、軟件交付)應(yīng)當(dāng)明確相應(yīng)的要求等�。
(4)在質(zhì)量控制方面,軟件的放行程序應(yīng)當(dāng)明確軟件版本�、完整性檢查等要求和記錄����。
更多有關(guān)上海醫(yī)療器械獨(dú)立軟件注冊需求����,歡迎您隨時(shí)方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò),聯(lián)系人:葉工���,電話:18058734169���,微信同。