目前基于大規(guī)模平行測(cè)序的高通量測(cè)序技術(shù)發(fā)展迅猛。不同于大多數(shù)體外診斷技術(shù)只能檢測(cè)到單一或確定的幾個(gè)指標(biāo)來(lái)診斷一種或幾種特定的疾病狀態(tài)��,高通量測(cè)序技術(shù)(Next Generation Sequencing�����,下文簡(jiǎn)稱(chēng)NGS)能夠檢測(cè)到人類(lèi)基因組中超過(guò)30億個(gè)堿基�,并由此識(shí)別出個(gè)體可能擁有的大約300萬(wàn)種遺傳變異。采用同品種比對(duì)完成醫(yī)療器械注冊(cè)的企業(yè)占有相當(dāng)比例��。
目前基于大規(guī)模平行測(cè)序的高通量測(cè)序技術(shù)發(fā)展迅猛�。不同于大多數(shù)體外診斷技術(shù)只能檢測(cè)到單一或確定的幾個(gè)指標(biāo)來(lái)診斷一種或幾種特定的疾病狀態(tài)��,高通量測(cè)序技術(shù)(Next Generation Sequencing�,下文簡(jiǎn)稱(chēng)NGS)能夠檢測(cè)到人類(lèi)基因組中超過(guò)30億個(gè)堿基,并由此識(shí)別出個(gè)體可能擁有的大約300萬(wàn)種遺傳變異��。目前主要應(yīng)用于無(wú)創(chuàng)產(chǎn)前篩查�、胚胎植入前遺傳學(xué)檢測(cè)、腫瘤基因突變和遺傳病等臨床檢測(cè)項(xiàng)目��。其檢測(cè)具有數(shù)據(jù)量高�、通量大、分析復(fù)雜等特點(diǎn)。
目前測(cè)序行業(yè)大規(guī)模應(yīng)用的高通量測(cè)序測(cè)序儀主要來(lái)源于Illumina��、Life Technologies和華大基因����。2005年第一臺(tái)Roche 454 Genome Sequencer 20面世,同時(shí)Illumina和Life Technologies也推出了各自的不同原理的測(cè)序平臺(tái)�����,之后兩家公司不斷推出了的一系列測(cè)序儀�����。Illumina于2010年推出了Hiseq系列�����,2011年推出臺(tái)式測(cè)序平臺(tái)Miseq�����,2014年發(fā)布了NextSeq 550�����,2016年推出了MiniSeq,2017年發(fā)布可擴(kuò)展的NovaSeq系列��。同時(shí)Life Technologies也推出了Ion PGM�����、Ion Proton及Ion GeneStudio S5系列��。華大基因也在基于Ion Torrent平臺(tái)的 BGISEQ-100與基于CG平臺(tái)的BGISEQ-1000后���,于2015年推出集成性的Revolocity測(cè)序儀和基于聯(lián)合探針錨定聚合技術(shù)與改進(jìn)的DNA納米球原理的BGISEQ-500����,并在2018年推出數(shù)據(jù)通量達(dá)到6TB的DNBSEQ-T7�。測(cè)序平臺(tái)日新月異,10余年內(nèi)����,產(chǎn)品更加成熟��,有集成一體的也有小型臺(tái)式機(jī)型�,錯(cuò)誤率不斷下降,測(cè)序通量不斷提高���,由原先的MB的通量發(fā)展到TB水平���。測(cè)序技術(shù)飛速發(fā)展����,也推動(dòng)監(jiān)管技術(shù)不斷發(fā)展�。
一.FDA的管理方式
從2011年,美國(guó)FDA開(kāi)始研究NGS的評(píng)價(jià)���,參與了科學(xué)界制定的相關(guān)的標(biāo)準(zhǔn)工作����,建立“下一代序列:臨床檢測(cè)標(biāo)準(zhǔn)化”工作組���,并開(kāi)展了一系列的研討會(huì)��。
FDA將臨床用高通量基因測(cè)序儀作為二類(lèi)(特別控制)醫(yī)療器械管理�。于2013年批準(zhǔn)了第一個(gè)基于Miseq Dx基因測(cè)序儀的兩個(gè)針對(duì)囊性纖維化的NGS產(chǎn)品����。產(chǎn)品評(píng)估的重點(diǎn)是如何使用有代表性的變異來(lái)評(píng)估儀器的分析性能,以及使用聚合的公共數(shù)據(jù)來(lái)支持檢測(cè)基因中變異的臨床相關(guān)性��。
雖然儀器應(yīng)該能夠準(zhǔn)確和可靠地檢測(cè)基因組序列中可能存在的每一個(gè)可能突變,但要求提供這樣的數(shù)據(jù)是不可行的�����,因此使用不同序列不同突變類(lèi)型的代表性變異數(shù)據(jù)集來(lái)證明了Miseq Dx的分析測(cè)試性能��,證明該變異數(shù)據(jù)集具有充分的分析性能����,合理保證測(cè)試能夠成功識(shí)別基因組中的相關(guān)變異,而不需要申請(qǐng)人提交測(cè)試可能識(shí)別的每一種可能變異的數(shù)據(jù)����。
FDA把基因測(cè)序產(chǎn)品定義為在特定NGS儀器(如Miseq Dx)上執(zhí)行的人類(lèi)DNA測(cè)序分析,其工作流程由標(biāo)準(zhǔn)操作程序定義��,其中指定了所有材料和程序���。因此�,對(duì)基因測(cè)序儀的管理也采用新的監(jiān)管方法����,將測(cè)序儀��、試劑及軟件整合作為整體來(lái)進(jìn)行批準(zhǔn),并對(duì)測(cè)序儀要求進(jìn)行標(biāo)簽清單的特殊控制管理���,而不是按照常規(guī)的IVD產(chǎn)品進(jìn)行獨(dú)立評(píng)價(jià)��。例如����,Illumina MiSeq Dx囊性纖維化臨床測(cè)序檢測(cè)由文庫(kù)制備和樣品提取試劑�、測(cè)序試劑和消耗品、MiSeq Dx儀器和數(shù)據(jù)分析軟件組成���。
二.我國(guó)基因測(cè)序儀的審評(píng)審批情況
在我國(guó)���,基因測(cè)序儀和建庫(kù)試劑均作為Ⅲ類(lèi)醫(yī)療器械進(jìn)行管理。雖然與FDA的監(jiān)管方式存在差異��,但我國(guó)也極為重視對(duì)基因測(cè)序儀的管理����。由于監(jiān)管法規(guī)體系的不同,我國(guó)對(duì)基因測(cè)序儀和建庫(kù)試劑���、測(cè)序試劑采取獨(dú)立審批的方式���。
我國(guó)自2014年首次批準(zhǔn)基因測(cè)序儀�,目前我國(guó)已有來(lái)自十多個(gè)公司的基于多種測(cè)序原理的基因測(cè)序儀產(chǎn)品獲得批準(zhǔn)����。
目前已上市的產(chǎn)品有基于可逆末端終止法的安諾優(yōu)達(dá)基因科技(北京)有限公司的基因測(cè)序儀NextSeq 550AR和Illumina公司的基因測(cè)序儀MiSeqTM Dx Instrument,NextSeq? 550Dx Instrument等���;基于半導(dǎo)體原理的Life 中山大學(xué)達(dá)安基因股份有限公司的基因測(cè)序儀DA8600和Technologies的PGM Dx等��;基于聯(lián)合探針錨定聚合技術(shù)與DNA納米球原理的武漢華大智造科技有限公司的基因測(cè)序儀BGISEQ-50和后續(xù)的MGISEQ機(jī)型等����。其中一部分測(cè)序儀采取臨床試驗(yàn)的路徑驗(yàn)證臨床性能����,另一部分產(chǎn)品采用同品種比對(duì)的路徑,與同原理的產(chǎn)品進(jìn)行對(duì)比分析�。(見(jiàn)下圖)
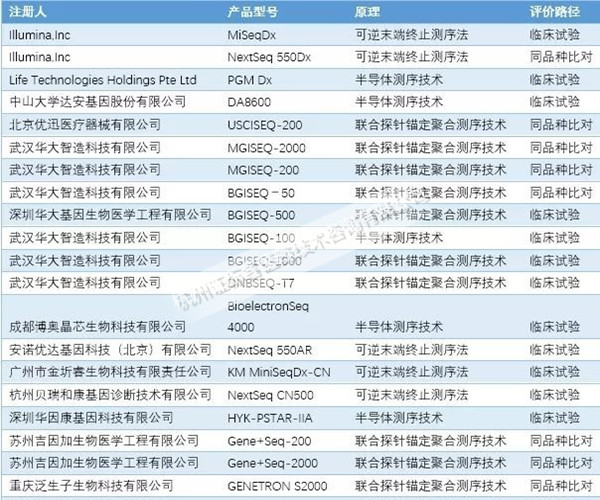
圖1:我國(guó)基因測(cè)序儀批準(zhǔn)情況
從上圖中我們可以看到,采用同品種比對(duì)臨床評(píng)價(jià)方式完成注冊(cè)的產(chǎn)品和企業(yè)占有較大比例�。
鑒于基因測(cè)序技術(shù)平臺(tái)具有操作和分析較為復(fù)雜的特點(diǎn),針對(duì)不同的檢測(cè)目的和預(yù)期用途�,采用的樣本類(lèi)型不同,而人類(lèi)和其他物種基因組信息和結(jié)構(gòu)的差異和多樣性會(huì)造成檢測(cè)的核苷酸類(lèi)型����、序列變異類(lèi)型、測(cè)序技術(shù)和性能指標(biāo)方法的差異�,例如不同的物種的基因組,不同的變異類(lèi)型�����,不同的核酸類(lèi)型會(huì)對(duì)基因測(cè)序儀產(chǎn)出的數(shù)據(jù)的質(zhì)量和通量有不同的要求����。因此需要采用有代表性的檢測(cè)項(xiàng)目來(lái)研究產(chǎn)品的臨床性能。
小結(jié):基因測(cè)序儀作為測(cè)序行業(yè)的上游關(guān)鍵技術(shù)����,其臨床性能的科學(xué)評(píng)價(jià)對(duì)于支持在臨床醫(yī)學(xué)的基于測(cè)序原理的檢驗(yàn)項(xiàng)目的健康發(fā)展具有重要意義。中美兩國(guó)都極為重視對(duì)基因測(cè)序儀安全有效性的科學(xué)評(píng)價(jià)和管理����。美國(guó)采取試劑、儀器及軟件整體評(píng)價(jià)的方式�,對(duì)于測(cè)序產(chǎn)品末端的結(jié)果的判讀具有嚴(yán)格的監(jiān)管。由于法規(guī)體系的不同����,我國(guó)采用與歐盟相同的監(jiān)管方式����,對(duì)基因測(cè)序儀和試劑獨(dú)立審批��,但產(chǎn)品同樣是作為一個(gè)整體進(jìn)行評(píng)價(jià)�。應(yīng)當(dāng)注意,針對(duì)NGS產(chǎn)品其自身特點(diǎn)����,產(chǎn)品評(píng)價(jià)中更多關(guān)注代表性目標(biāo)的覆蓋性與性能。隨著行業(yè)的發(fā)展和對(duì)產(chǎn)品認(rèn)知的提升�,也促使我們需要進(jìn)一步研究和建立更為科學(xué)的臨床評(píng)價(jià)方法,以支持基于測(cè)序原理的檢驗(yàn)項(xiàng)目的健康發(fā)展��。
(文章來(lái)源:2021-10-21 CMDE 中國(guó)器審)