風(fēng)險(xiǎn)管理是ISO13485認(rèn)證重點(diǎn)之一
發(fā)布日期:2020-12-06 15:57瀏覽次數(shù):4835次
基于風(fēng)險(xiǎn)的管理是近年管理界的主流趨勢�����,風(fēng)險(xiǎn)也是ISO13485認(rèn)證標(biāo)準(zhǔn)及認(rèn)證活動管控的最重要事項(xiàng)之一����,也是醫(yī)療器械安全有效性管理的核心之一。
引言:基于風(fēng)險(xiǎn)的管理是近年管理界的主流趨勢���,風(fēng)險(xiǎn)也是ISO13485認(rèn)證標(biāo)準(zhǔn)及認(rèn)證活動管控的最重要事項(xiàng)之一�����,也是醫(yī)療器械安全有效性管理的核心之一�����。
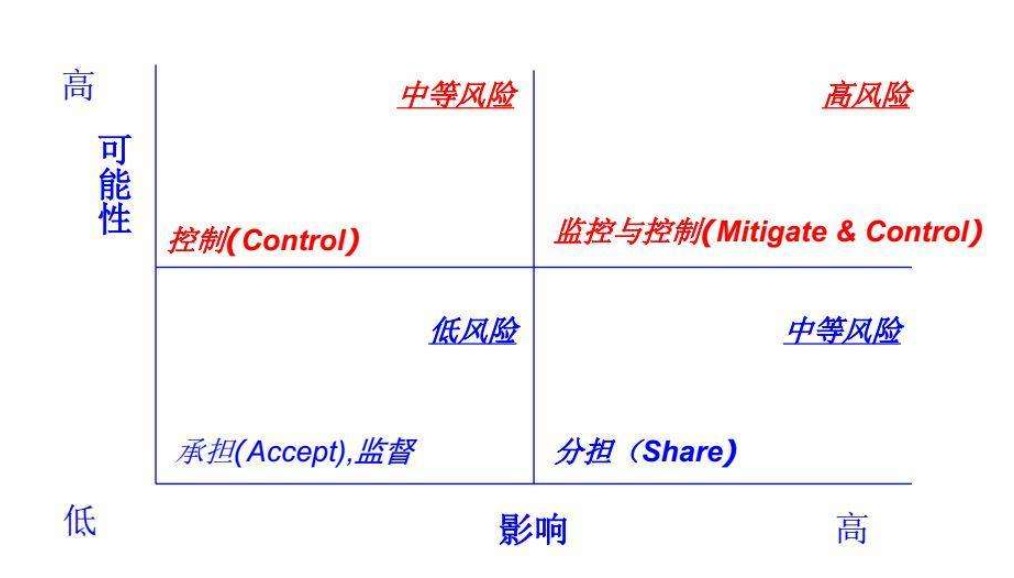
風(fēng)險(xiǎn)管理是用于風(fēng)險(xiǎn)分析����、評價��、控制和監(jiān)視工作的管理方針���、程序及其實(shí)踐的系統(tǒng)運(yùn)用��,貫穿于醫(yī)療器械從設(shè)計(jì)開發(fā)過程的初始概念至最終停用和處置的全生命周期�����,在保障醫(yī)療器械產(chǎn)品臨床使用安全性和有效性上得到了全面的應(yīng)用�。醫(yī)療器械作為應(yīng)用于人體的醫(yī)療用品,應(yīng)保證臨床產(chǎn)品應(yīng)用對患者受益大于風(fēng)險(xiǎn)����,在為患者帶來臨床受益的同時,最大程度控制器械在應(yīng)用中可能帶來的風(fēng)險(xiǎn)����。醫(yī)療器械監(jiān)管法規(guī)、標(biāo)準(zhǔn)等構(gòu)成的醫(yī)療器械性能評價體系對醫(yī)療器械性能評價進(jìn)行了較為完善的規(guī)定和要求���。本文對風(fēng)險(xiǎn)管理在醫(yī)療器械性能評價的應(yīng)用從法規(guī)要求���、質(zhì)量管理體系�、產(chǎn)品性能評價體系構(gòu)建等方面進(jìn)行淺析,希望能為醫(yī)療器械監(jiān)管科學(xué)研究和風(fēng)險(xiǎn)精準(zhǔn)控制的醫(yī)療器械性能評價體系構(gòu)建提供參考��。
一�����、風(fēng)險(xiǎn)管理應(yīng)貫穿醫(yī)療器械全生命周期
風(fēng)險(xiǎn)管理理念與質(zhì)量管理體系的融合形成了保障醫(yī)療器械產(chǎn)品安全性和有效性的科學(xué)手段����,風(fēng)險(xiǎn)因素識別分析���、風(fēng)險(xiǎn)控制、風(fēng)險(xiǎn)評價在產(chǎn)品實(shí)現(xiàn)的策劃�、設(shè)計(jì)開發(fā)、生產(chǎn)交付和上市后信息收集中進(jìn)行了應(yīng)用���,上市后信息在風(fēng)險(xiǎn)因素識別中的作用也得到了越來越多的重視����,實(shí)現(xiàn)了醫(yī)療器械全生命周期風(fēng)險(xiǎn)可控的識別�、控制和風(fēng)險(xiǎn)可接受性評估。
在醫(yī)療器械全生命周期中��,設(shè)計(jì)開發(fā)策劃���、輸入����、輸出����,以及驗(yàn)證、確認(rèn)、轉(zhuǎn)換過程均需要產(chǎn)品性能評價方法的支持��,風(fēng)險(xiǎn)管理中對風(fēng)險(xiǎn)的識別質(zhì)量決定了產(chǎn)品性能評價方法構(gòu)建的科學(xué)性和適合性����,因此在風(fēng)險(xiǎn)管理計(jì)劃時應(yīng)在醫(yī)療器械風(fēng)險(xiǎn)分析過程中對風(fēng)險(xiǎn)充分識別。法規(guī)��、標(biāo)準(zhǔn)��、同類產(chǎn)品信息(原材料����、生產(chǎn)工藝、結(jié)構(gòu)設(shè)計(jì)等開發(fā)產(chǎn)品類似設(shè)計(jì)在人體應(yīng)用歷史)等在長期醫(yī)療器械管理中積累的認(rèn)識對產(chǎn)品實(shí)現(xiàn)具有重要的幫助作用�����,其中影響到產(chǎn)品關(guān)鍵性能的共性要求��,基于對滿足產(chǎn)品臨床應(yīng)用需要被列入強(qiáng)制性標(biāo)準(zhǔn)���,設(shè)計(jì)和開發(fā)輸入應(yīng)能夠充分的、全面的對產(chǎn)品相關(guān)要求和臨床風(fēng)險(xiǎn)因素進(jìn)行識別��。
行業(yè)標(biāo)準(zhǔn)YY/T 0316-2016《醫(yī)療器械風(fēng)險(xiǎn)管理對醫(yī)療器械的應(yīng)用》中對風(fēng)險(xiǎn)的分析���,要求制造商應(yīng)識別可能影響醫(yī)療器械安全的定性和定量特征并形成文件�,并對已識別的危險(xiǎn)情況都應(yīng)利用可獲得的資料或數(shù)據(jù)估計(jì)與其相關(guān)的風(fēng)險(xiǎn)。標(biāo)準(zhǔn)還對用于風(fēng)險(xiǎn)估計(jì)的常用資料做了介紹�,分別為已發(fā)布的標(biāo)準(zhǔn)、科學(xué)技術(shù)資料���、已在使用中的類似醫(yī)療器械的現(xiàn)場資料(包括已公布的事故報(bào)告)��、由典型使用者進(jìn)行的可用性實(shí)驗(yàn)�����、臨床證據(jù)����、適當(dāng)?shù)恼{(diào)研結(jié)果��、專家意見�����、外部質(zhì)量評定情況��。將識別的風(fēng)險(xiǎn)隱私通過風(fēng)險(xiǎn)評價、風(fēng)險(xiǎn)控制����、剩余風(fēng)險(xiǎn)評價、風(fēng)險(xiǎn)/受益分析�����,經(jīng)風(fēng)險(xiǎn)控制的完整性評價和綜合剩余風(fēng)險(xiǎn)的可接受性評價����,在所有的風(fēng)險(xiǎn)控制措施已經(jīng)實(shí)施并驗(yàn)證后,利用風(fēng)險(xiǎn)管理計(jì)劃中的準(zhǔn)則決定醫(yī)療器械造成的綜合剩余風(fēng)險(xiǎn)是否可接受�����,形成風(fēng)險(xiǎn)管理報(bào)告���。
設(shè)計(jì)和開發(fā)作為產(chǎn)品實(shí)現(xiàn)的重要過程�����,《醫(yī)療器械注冊管理辦法》中規(guī)定醫(yī)療器械注冊申請人應(yīng)當(dāng)建立與產(chǎn)品研制、生產(chǎn)有關(guān)的質(zhì)量管理體系����,并保持有效運(yùn)行�����。在對醫(yī)療器械產(chǎn)品性能評價時�,設(shè)計(jì)和開發(fā)輸入質(zhì)量越來越受到重視����,其涉及到產(chǎn)品的工作原理、結(jié)構(gòu)組成��、制造材料���、性能指標(biāo)��、作用方式以及適用范圍設(shè)定的科學(xué)性和支持依據(jù)的充分性�。將與有充分臨床應(yīng)用歷史數(shù)據(jù)支撐的同類或前代產(chǎn)品相同的作用方式��、材料�����、結(jié)構(gòu)等特征�,通過對同類產(chǎn)品信息(性能指標(biāo)和臨床應(yīng)用數(shù)據(jù))的輸入�����,從而更為客觀����、準(zhǔn)確地評價產(chǎn)品臨床應(yīng)用風(fēng)險(xiǎn)�,避免將過多已經(jīng)有同類產(chǎn)品數(shù)據(jù)支持的風(fēng)險(xiǎn)因素作為敞口風(fēng)險(xiǎn),依賴具有局限性的產(chǎn)品性能研究���、臨床評價過程來論證產(chǎn)品臨床應(yīng)有的安全性和有效性��,造成研究工作的重復(fù)低效開展��。牛頓富有哲理的名言“如果說我看得比別人更遠(yuǎn)些�,那是因?yàn)槲艺驹诰奕说募绨蛏稀?���,在醫(yī)療器械產(chǎn)品風(fēng)險(xiǎn)管理上也適用,在進(jìn)行醫(yī)療器械產(chǎn)品性能評價時��,要注重對同類/前代產(chǎn)品進(jìn)行充分的輸入�,將同類/前代產(chǎn)品作為設(shè)計(jì)依據(jù)的要素通過同類產(chǎn)品數(shù)據(jù)論證產(chǎn)品臨床應(yīng)用的安全性和有效性,有針對性地準(zhǔn)確控制產(chǎn)品風(fēng)險(xiǎn)��。醫(yī)療器械產(chǎn)品性能評價過程中設(shè)計(jì)和開發(fā)輸入的充分性�����,同樣對產(chǎn)品創(chuàng)新部分風(fēng)險(xiǎn)的識別也具有重要作用�,深入掌握和理解同類/前代產(chǎn)品中研究成果,才能更好掌握材料��、結(jié)構(gòu)設(shè)計(jì)����、生產(chǎn)工藝等產(chǎn)品實(shí)現(xiàn)要素與產(chǎn)品臨床使用安全性有效性的關(guān)系。
對于上市后醫(yī)療器械臨床應(yīng)用風(fēng)險(xiǎn)管理�,行業(yè)標(biāo)準(zhǔn)YY/T 0316-2016《醫(yī)療器械風(fēng)險(xiǎn)管理對醫(yī)療器械的應(yīng)用》要求建立、形成文件并保持一個系統(tǒng)�����,以便收集和評審醫(yī)療器械相關(guān)信息���,并注意對類似醫(yī)療器械公開信息的收集和評審�,將收集的數(shù)據(jù)用于對風(fēng)險(xiǎn)管理活動的評價�����。設(shè)計(jì)和開發(fā)過程的驗(yàn)證、確認(rèn)等研究�����,具有抽樣的特征�����,易受到主觀因素�����、操作規(guī)范性的影響��,與此相比�,上市后臨床應(yīng)用數(shù)據(jù)具有數(shù)據(jù)量大、能準(zhǔn)確反應(yīng)臨床應(yīng)用實(shí)際����,可以作為對醫(yī)療器械產(chǎn)品的全生命周期風(fēng)險(xiǎn)管理的有益補(bǔ)充。同時收集的產(chǎn)品臨床應(yīng)用反饋可用于產(chǎn)品再次改進(jìn)設(shè)計(jì)的設(shè)計(jì)依據(jù)和臨床應(yīng)用新需求的設(shè)計(jì)輸入����,不斷實(shí)現(xiàn)產(chǎn)品設(shè)計(jì)的迭代升級。真實(shí)世界數(shù)據(jù)可避免傳統(tǒng)隨機(jī)對照臨床試驗(yàn)樣本規(guī)模受限��、臨床方案排除的某些風(fēng)險(xiǎn)因素可能給器械臨床應(yīng)用帶來的風(fēng)險(xiǎn),以及在解決臨床使用可及性方面被相關(guān)研究機(jī)構(gòu)研究和應(yīng)用����,其在醫(yī)療器械產(chǎn)品風(fēng)險(xiǎn)管理中的作用日益受到重視�。
二、構(gòu)建科學(xué)高效風(fēng)險(xiǎn)管理的醫(yī)療器械產(chǎn)品性能評價體系
醫(yī)療器械產(chǎn)品的設(shè)計(jì)和開發(fā)過程中��,隨著新材料���、新技術(shù)的不斷引入應(yīng)用和新的臨床需求提出�����,新開發(fā)的產(chǎn)品會具有與前代/同類已上市產(chǎn)品不同的特征����,對其風(fēng)險(xiǎn)識別�、控制和評價需要在現(xiàn)有標(biāo)準(zhǔn)、質(zhì)控指標(biāo)的基礎(chǔ)上�,構(gòu)建能夠適應(yīng)科學(xué)高效風(fēng)險(xiǎn)管理的產(chǎn)品性能評價體系。
在性能評價體系構(gòu)建中���,風(fēng)洞實(shí)驗(yàn)將飛行器或物體周圍空氣實(shí)際流動狀態(tài)���,以在等效性模型加載各項(xiàng)條件的形式����,在人工產(chǎn)生和控制氣流的實(shí)驗(yàn)環(huán)境下仿真模擬�,實(shí)現(xiàn)了對氣動、結(jié)構(gòu)�����、材料�����、工藝�、熱力學(xué)等多個學(xué)科領(lǐng)域技術(shù)進(jìn)行系統(tǒng)集成,可量度氣流對實(shí)體的作用效果和觀察物理現(xiàn)象的空氣動力實(shí)驗(yàn)工具�,隨著工業(yè)空氣動力學(xué)的發(fā)展,其在交通運(yùn)輸�、房屋建筑、風(fēng)能利用等領(lǐng)域廣泛應(yīng)用�,并對其它性能評價體系構(gòu)建提供了較好的參考價值[1]。
新原理���、新材料����、新結(jié)構(gòu)設(shè)計(jì)、新工藝等不斷在醫(yī)療器械創(chuàng)新中研究和應(yīng)用���,臨床使用方法��、作用方式也在不斷改進(jìn)�,在醫(yī)療器械產(chǎn)品性能評價體系構(gòu)建中可參照風(fēng)洞理論體系��,結(jié)合識別的新引入風(fēng)險(xiǎn)�����,構(gòu)建能夠反映臨床應(yīng)用實(shí)際��、考量多因素交互作用�����、可穩(wěn)定準(zhǔn)確輸出評價結(jié)果的性能評價體系和評價模型����。評價體系和模型的構(gòu)建可充分利用已有數(shù)據(jù),將已有研究數(shù)據(jù)在驗(yàn)證后形成性能指標(biāo)體系����。同時,評價體系的構(gòu)建將對數(shù)據(jù)的有效積累和輸出結(jié)果的評價分析提供平臺支持�����。
評價體系和評價模型輸出結(jié)果與臨床應(yīng)用反饋進(jìn)行比對�����,通過對評價體系中加載條件和參數(shù)設(shè)定的改進(jìn)和完善�����,使評價體系對臨床應(yīng)用的預(yù)測能力逐步提升�。產(chǎn)品的性能指標(biāo)是臨床使用性能的決定因素之一,對其的研究和數(shù)據(jù)積累將有利于對產(chǎn)品設(shè)計(jì)的原理和要求的認(rèn)識���,提升產(chǎn)品設(shè)計(jì)的針對性���、合理性和科學(xué)性。
三����、歐美國家醫(yī)療器械評價中對風(fēng)險(xiǎn)管理應(yīng)用的借鑒
面對醫(yī)療器械新材料����、新技術(shù)創(chuàng)新應(yīng)用的蓬勃發(fā)展和更好保障醫(yī)療器械安全性和有效性�����,滿足臨床可及性的要求����,歐美等國家的監(jiān)管模式也不斷進(jìn)行改進(jìn)和探索,其中對風(fēng)險(xiǎn)的有效控制是行業(yè)監(jiān)管和產(chǎn)品性能評價過程中重要考量點(diǎn)�。
美國FDA在2016年更新了《醫(yī)療器械上市前批準(zhǔn)(PMA)和分類界定中風(fēng)險(xiǎn)受益評估考量因素指導(dǎo)原則》,該指導(dǎo)原則將醫(yī)療器械產(chǎn)品在臨床應(yīng)用中的風(fēng)險(xiǎn)受益對比�、支持證據(jù)強(qiáng)度��、同類產(chǎn)品風(fēng)險(xiǎn)受益情況等方面內(nèi)容用于對醫(yī)療器械性能評價��,并可將上市后數(shù)據(jù)應(yīng)用于受益風(fēng)險(xiǎn)判定���,制定了提高評價科學(xué)性的受益風(fēng)險(xiǎn)評估工作清單��,導(dǎo)則體現(xiàn)了風(fēng)險(xiǎn)管理在醫(yī)療器械性能評價的重要作用[2-4]�。在性能評價體系構(gòu)建用于風(fēng)險(xiǎn)受益評價方面,該導(dǎo)則指出基于臨床試驗(yàn)可能的局限性���,在對器械最差情形型號產(chǎn)品和長期使用性能等方面更傾向于通過性能評價體系中功能試驗(yàn)來進(jìn)行產(chǎn)品臨床受益風(fēng)險(xiǎn)評估���,體現(xiàn)了針對性識別風(fēng)險(xiǎn)的重要性,精準(zhǔn)的風(fēng)險(xiǎn)識別更有助于通過有效的研究實(shí)現(xiàn)科學(xué)高效的風(fēng)險(xiǎn)管理����。美國FDA還將受益風(fēng)險(xiǎn)評估應(yīng)用于臨床試驗(yàn)開展、尚無有效治療手段相關(guān)醫(yī)療器械評價�、產(chǎn)品安全性提升“STeP”等方面[5-6]。
歐盟2017年發(fā)布的醫(yī)療器械監(jiān)管法規(guī)(REGULATION (EU) 2017/745)要求風(fēng)險(xiǎn)管理體系應(yīng)能在器械的臨床評估過程應(yīng)用并與其保持一致��,將醫(yī)療器械臨床使用風(fēng)險(xiǎn)管理增加到臨床研究��、臨床評估和上市后臨床跟蹤中�����,風(fēng)險(xiǎn)管理和臨床評價過程應(yīng)相互依存��,并定期更新���。新法規(guī)要求醫(yī)療器械生產(chǎn)商收集上市后臨床數(shù)據(jù)定期更新臨床評估報(bào)告來管理產(chǎn)品臨床應(yīng)用風(fēng)險(xiǎn)�,讓風(fēng)險(xiǎn)管理在臨床評價中的應(yīng)用貫穿于醫(yī)療器械全生命周期。歐盟醫(yī)療器械監(jiān)管法規(guī)更加重視醫(yī)療器械產(chǎn)品風(fēng)險(xiǎn)管理����,對在醫(yī)療器械全生命周期應(yīng)用風(fēng)險(xiǎn)管理的要求進(jìn)一步加強(qiáng)。
目前國家藥監(jiān)局圍繞審評審批制度改革�����,開展監(jiān)管科學(xué)研究��,通過新標(biāo)準(zhǔn)����、新工具和新方法等系列創(chuàng)新,提高審評審批質(zhì)量和效率���,營造利于創(chuàng)新驅(qū)動發(fā)展的良好監(jiān)管生態(tài)環(huán)境�����。風(fēng)險(xiǎn)管理應(yīng)與質(zhì)量管理體系、產(chǎn)品性能評價體系構(gòu)建有機(jī)結(jié)合����,應(yīng)用于醫(yī)療器械性能評價過程�����,通過風(fēng)險(xiǎn)管理的應(yīng)用�����,建立更為精準(zhǔn)的風(fēng)險(xiǎn)控制方法和模式����,在減少低效重復(fù)性研究評價工作�、縮減產(chǎn)品性能評價時間的同時,更為高效����、準(zhǔn)確的實(shí)現(xiàn)對風(fēng)險(xiǎn)的識別、控制和剩余風(fēng)險(xiǎn)的可接受性評價���。通過醫(yī)療器械產(chǎn)品風(fēng)險(xiǎn)精準(zhǔn)控制的性能評價體系建設(shè)�����,提升科研成果轉(zhuǎn)化效率�����、推動醫(yī)療器械行業(yè)的高質(zhì)量發(fā)展和醫(yī)療器械產(chǎn)品供給側(cè)改革�,更好服務(wù)于公眾的醫(yī)療和健康需求。
近幾年�,我們看到的多數(shù)處罰公告,都可歸結(jié)為企業(yè)ISO13485認(rèn)證體系執(zhí)行缺陷����,更進(jìn)一步,我們可以認(rèn)為是有關(guān)醫(yī)療器械風(fēng)險(xiǎn)管理的缺失��。