輸注產(chǎn)品針刺傷防護裝置要求與評價技術(shù)審查指導原則
一����、前言
全球范圍內(nèi)因不安全輸注所致醫(yī)護人員職業(yè)暴露及感染問題一直存在。安全輸注是阻斷感染傳播�、保障患者安全及醫(yī)務(wù)人員職業(yè)安全的基本路徑和有效措施。安全輸注指對接受輸注者無害�,對實施輸注的醫(yī)護人員不帶來任何可避免的危險,廢棄物不對社會造成危害�����。
近年來,隨著安全防護意識增強以及技術(shù)手段和臨床醫(yī)療探索研究不斷發(fā)展,針刺傷防護裝置被整合為輸注類器械產(chǎn)品(如注射針、輸液針��、靜脈留置針等)的組件,為安全輸注提供了新的實現(xiàn)路徑與方法�。為規(guī)范和指導輸注類產(chǎn)品針刺傷防護裝置的要求與評價����,制定本指導原則。
由于輸注類產(chǎn)品針刺傷防護裝置設(shè)計差異性較大且發(fā)展迅速�,本原則主要基于目前的認知,提出涉及針刺傷防護裝置安全�����、有效���、質(zhì)量可控的要求及評價內(nèi)容�����。此外�,由于針刺傷防護裝置僅為輸注產(chǎn)品的組件�����,注冊申請人需根據(jù)產(chǎn)品自身特點,參考本指導原則和輸注類產(chǎn)品強制性標準等技術(shù)文件撰寫產(chǎn)品注冊申報技術(shù)資料���。
二�����、范圍
本指導原則旨在規(guī)范和指導輸注類產(chǎn)品針刺傷防護裝置的要求與評價���。針刺傷防護裝置是指按醫(yī)療器械預期用途使用時,可主動或被動激活的防護組件��,旨在預防或減少因意外針刺傷而導致的疾病傳播��。
用于采集動靜脈血樣的采血針���,其針刺傷防護裝置要求與評價可參考本指導原則�����。
本指導原則不包括無針注射系統(tǒng)�、銳器處理盒�����、自毀型注射器等其他安全輸注相關(guān)器械。
三�、器械描述
注冊申請人應(yīng)通過產(chǎn)品標識或隨附文件等信息闡明防護裝置的類型。應(yīng)有圖示直觀顯示針刺傷防護裝置在防護前及防護后的不同狀態(tài)����。建議首次上市產(chǎn)品以列表形式比較本產(chǎn)品與已上市具有針刺傷防護功能器械的異同之處,比較內(nèi)容包括:適用范圍��、設(shè)計特征�、材質(zhì)��、規(guī)格和尺寸�、防護機制及工作原理等。應(yīng)著重闡述差異部分對產(chǎn)品針刺傷防護功能的影響���。
作為輸注類醫(yī)療器械產(chǎn)品的組件�,在設(shè)計時應(yīng)考慮針刺傷防護裝置的引入是否會影響產(chǎn)品的主體功能�����,因此在描述物理性能時���,建議針對以下參數(shù)與無防護裝置的產(chǎn)品進行比較:
對主體功能可能有影響的結(jié)構(gòu)幾何尺寸
防護裝置與針管/針尖的配合
預充容量(若適用)
注射輸液港或注射器中的殘留容量
安全結(jié)構(gòu)強度(例如拉伸����、彎曲、伸長等)
接頭�、粘接處等的強度
任何可能影響使用的透明度不良(例如回血或針插入皮膚的可視性)
標記和刻度:顏色、刻度類型����、指示是否可以在所有使用條件下讀取刻度(例如預充式注射器,針尖護套在使用前縮回時)
? 器械任何其他獨特的物理特性和規(guī)格��。
四�����、安全防護裝置的要求
安全防護裝置按照防護原理分為主動安全性裝置和被動安全性裝置�����。主動安全性裝置是指使用者需要執(zhí)行額外步驟才能激活針刺傷防護功能����,與執(zhí)行器械主要預期功能所需的任何操作分開執(zhí)行。被動安全性裝置是指使用者無需執(zhí)行額外步驟即可激活針刺傷防護功能�。
(一)通用要求
1.在預期使用條件下����,一旦處于安全模式�,器械的安全功能應(yīng)提供對意外針刺傷的防護,直至安全完成廢棄處置�����。
2.應(yīng)使使用者能明顯知曉器械何時處于安全模式����。
安全模式激活的信息應(yīng)通過視覺、觸覺和/或聽覺手段清晰無誤地傳達給使用者����。
3.應(yīng)基于風險評估確定適當?shù)募せ盍Α?/span>
可通過使用患者替代品(例如教學模型)模擬實際臨床使用提供支持���。研究設(shè)計應(yīng)當基于統(tǒng)計學考慮�,并應(yīng)有明確的接受標準�。
4.針刺傷防護裝置激活后使用者的手或其他部位與針尖保持一定的距離或有效的物理隔離。安全功能可以主動或被動地操作�����。如果需要主動激活,建議單手操作����。
5.防護裝置的安全性能不應(yīng)妨礙或影響器械預期的臨床使用性能;在預期使用條件下應(yīng)能防止意外激活��;對正常使用后的處理不產(chǎn)生負面影響����。
上述性能應(yīng)通過在指定使用條件下進行適當?shù)哪M或者臨床使用研究來證明。
(二)防護裝置的激活
1.主動刺傷防護功能應(yīng)能在按預期使用后即刻激活����。
2.被動刺傷防護功能應(yīng)在按預期使用后即刻進入安全模式。
3.針刺傷防護裝置應(yīng)確保器械能實現(xiàn)預期使用功能�,應(yīng)保證激活方便并且可避免意外激活。
建議注冊申請人基于風險評估方法確定申報產(chǎn)品激活刺傷防護功能的力值����。
(三)防護裝置的安全性
1.一旦進入安全模式,該防護裝置必須對針尖意外暴露有足夠的抵抗力��,并且能將意外接觸針尖的風險降至最低��。
2.注冊申請人應(yīng)基于風險評估的方法,確定防護裝置失效的最小力值���。
(四)其他
建議通過與已上市類似功能器械進行對比����,模擬最惡劣情況進行評估���,并描述如何確定所使用的最惡劣情況��。測試評估包括但不限于以下內(nèi)容:
安全裝置連接處的連接力和/或分離力
激活和破壞安全功能的力
由激活機制產(chǎn)生的反作用力(例如所含的彈性組件)
防護裝置的抗穿刺性
模擬極端壓力的防護裝置性能(例如向活塞施加最大力或通過輸液接口的最大流量)
輸注劑量的準確性
老化前和老化后的防護功能
五����、安全防護裝置的評價
安全防護裝置的評價應(yīng)能說明一旦器械處于安全模式��,會將意外接觸針尖的風險降至最低�����。
(一)安全模式下的接觸測試
基于工程制造針刺傷防護器械的個性化設(shè)計��,應(yīng)通過特定的測試方法和/或通過工程研究/計算機輔助設(shè)計分析證明此類意外接觸的風險得到了最大程度降低�。
應(yīng)考慮可用性工程(針對醫(yī)療器械)因素����,以評估并降低在正確使用和錯誤使用的情況下相關(guān)可用性問題所造成的風險��。
以下測試方法可用于測試在安全模式下意外接觸的風險���。
半徑為6毫米(模擬指尖)球體在靠近激活后器械的安全功能裝置時不應(yīng)接觸針尖或銳器的末端。對于具有貫穿管腔的鈍化安全功能的帶針器械����,當球體位于延伸的鈍化功能裝置前方并與其成一條線時,球體不應(yīng)接觸針尖�����。
也可以通過工程研究/計算機分析代替上述目視檢驗來證明對針尖的接觸情況����。
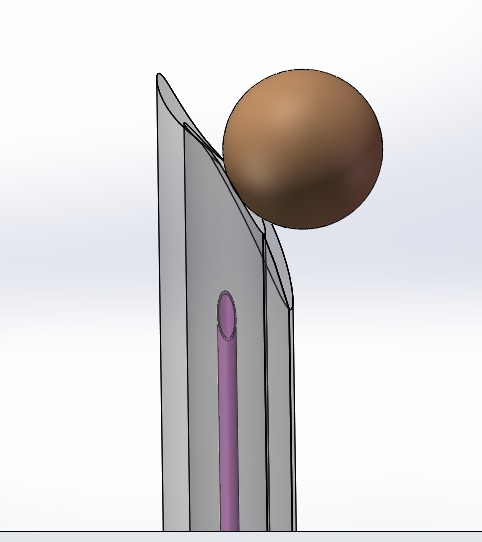
圖1 指尖模擬移動圖示
根據(jù)器械的預期用途、環(huán)境背景和用戶概況�,也可以考慮使用根據(jù)風險評定確定的不同半徑的球體。
(二)模擬臨床使用測試
對于包含針刺傷防護功能的器械���,建議進行模擬臨床使用測試�,并提供對模擬臨床使用測試結(jié)果的分析以及結(jié)果和結(jié)論的總結(jié)�����。模擬使用測試通過使用患者替代品(例如教學模型)來模擬實際臨床使用。模擬使用測試有助于排除器械問題����、優(yōu)化器械設(shè)計、識別標簽標識的缺陷���、評估器械使用者所需的培訓類型����。
建議制定一個針對該類器械的特定方案�。方案應(yīng)當基于統(tǒng)計學考慮,例如樣本量�����、因變量��,通過/未通過標準����,綜合報告表格/問卷,適當控制和適當?shù)慕y(tǒng)計測試方法����。該方案應(yīng)有明確的評價目標及評價參數(shù)、明確樣本量的確定依據(jù)����、評價人員的選擇及數(shù)量、并闡明數(shù)據(jù)分析方法����。
1.研究設(shè)計
評價人員應(yīng)當包括常規(guī)使用所評價器械的醫(yī)療專業(yè)人員。專業(yè)人員進行的模擬臨床使用評價有助于避免學習曲線偽差����。建議通過選擇足夠數(shù)量的評價人員,且每位使用足量的器械樣品(例如每位評價人員使用樣品總量的1/8)��,以便于最大程度減少偏倚�����。在多個測試地點進行的研究將減少測試偏倚�。
器械應(yīng)當在模擬關(guān)鍵臨床變量的條件下進行測試(例如,模擬患者的模型��、模擬臨床實際操作流程)����。
2.評價人員培訓
建議根據(jù)研究方案為評價人員提供培訓�,以確保操作的一致性��,對通用預防措施遵守情況的模擬�����,觀察��、評分和評價的一致性��,以及數(shù)據(jù)收集的完整性����。
3.報告表格
評價人員應(yīng)當在報告表格(即評價人員問卷)上記錄測試結(jié)果。建議記錄以下內(nèi)容:
(1)評價人員的特征和經(jīng)驗(例如����,左手操作或右手操作、根據(jù)規(guī)定量表衡量的手的大小����、性別、年齡��、使用的類似器械的數(shù)量/天數(shù),工作環(huán)境)�。
(2)評價人員使用器械的數(shù)量和類型�����。
(3)執(zhí)行器械的預期功能�����,例如注射����、輸注液體。
(4)觀察重要使用性能指標�����,例如刻度�、回血。
(5)常規(guī)操作的任何必要變化�,例如單手使用的改變。
(6)包裝設(shè)計保證器械在使用前保持無菌的能力�。
(7)激活安全功能的難易度,以及對非預期激活的防護情況�����。
(8)遇到的所有不良反應(yīng)或問題,例如針刺傷����、安全功能未能保持激活狀態(tài)、管路斷開等�����。
(9)與已上市對照器械相比���,使用防護裝置所需的時間以及對用戶接受度的影響��。
(10)發(fā)現(xiàn)安全功能激活情況的能力���,以及對在實際臨床使用過程中可能遇到的與檢測相關(guān)問題的意見。
(11)對使用器械的學習曲線(難易程度)的看法�����。
(12)對器械可接受性的評估�����。
(13)其他意見。
應(yīng)報告所有數(shù)據(jù)��,包括任何未通過的測試���。如果測試中出現(xiàn)了不合格��,建議提供此不合格項的詳細說明以及為確保不合格項得到糾正所采取的措施。
4.樣本量確定
樣本量可以基于在“N”件器械的測試運行中觀察到的不合格率的置信區(qū)間����。“不合格”的定義為針刺傷防護失效��。置信區(qū)間上限可作為器械的“真實”不合格率的最壞情況近似值����。
建議使用國際公認的適當統(tǒng)計軟件。例如使用STAT EXACT TURBO生成的以下表格列出了基于不同件數(shù)器械測試樣品中觀察到0件�、1件、2件或3件不合格項二項分布獲得的95%和99%置信區(qū)間上限��。
95%置信區(qū)間上限
| 測試器械數(shù)量 |
不合格數(shù) | 100 | 200 | 500 | 1000 |
0 | 3.6% | 1.8% | 0.7% | 0.3% |
1 | 5.4% | 2.7% | 1.1% | 0.6% |
2 | 6.9% | 3.5% | 1.4% | 0.7% |
3 | 8.3% | 4.3% | 1.7% | 0.9% |
99%置信區(qū)間上限
| 測試器械數(shù)量 |
不合格數(shù) | 100 | 200 | 500 | 1000 |
0 | 5.2% | 2.6% | 1.1% | 0.5% |
1 | 7.1% | 3.6% | 1.5% | 0.7% |
2 | 8.8% | 4.5% | 1.8% | 0.9% |
3 | 10.3% | 5.3% | 2.2% | 1.1% |
由于置信區(qū)間通常同時涉及上限和下限��,因此當僅處理一個限值時����,95%和99%的實際置信水平分別變?yōu)?7.5%和99.5%��。
該模型顯示�,即使沒有報告任何不合格����,樣本量較小也會增加接受具有潛在較高傷害率的器械的可能性。因此建議該模擬臨床使用測試包括足夠數(shù)量的器械���,以提供對器械防護性能的置信度�����。一般認為測試500件器械可以檢測到1%水平的嚴重缺陷器械���。
樣本量為500時,防護功能的不合格數(shù)應(yīng)為零�。由于根據(jù)上述置信區(qū)間將終點預先確定為0%的傷害率,因此不需要測試對照器械來比較針刺傷終點�。
如果提出的替代方法有充分的科學依據(jù)支持,可考慮確定樣本量的替代方法�����。
六、風險管理
按照YY/T 0316-2016《醫(yī)療器械風險管理對醫(yī)療器械的應(yīng)用》標準要求����,對產(chǎn)品生命周期全過程實施風險管理。評價應(yīng)至少確保:風險管理計劃已被適當?shù)貙嵤?��;綜合剩余風險是可接受的�����;已有適當方法獲得相關(guān)生產(chǎn)和生產(chǎn)后信息。評價結(jié)果應(yīng)形成風險管理報告���。
已識別針刺傷防護裝置的風險應(yīng)至少考慮以下方面:
風險類別 | 具體示例 |
設(shè)計不當及生產(chǎn)環(huán)節(jié)風險 | 不能正確激活防護裝置����; 用戶不能很容易判斷是否已激活針刺傷防護功能�; 針尖護套未能完全封閉針尖; 針尖未能完全縮回至器械外殼內(nèi)�; 外殼雖超出針頭,但未能防止手指進入�����; 未能在廢棄處置之前一直保持防護功能; 標簽未能區(qū)分防護裝置�; 影響產(chǎn)品預期使用; 零部件加工精度不當�����; 裝配不當����。 |
運輸和儲存風險 | 不恰當?shù)陌b;污染���;運輸中防護裝置脫位/脫落/激發(fā)����;器身損壞�����;儲存環(huán)境不當�����。 |
使用風險 | 說明書中應(yīng)明示產(chǎn)品應(yīng)由經(jīng)培訓的專業(yè)人員使用; 包裝標記不當���,如會產(chǎn)生重復使用的危害�,引起交叉感染�����; 對一次性使用的醫(yī)療器械很可能再次使用的危害警告不適當���,造成重復使用����; 使用方法說明不當��,造成操作錯誤�; 使用者未按規(guī)范程序使用��。 |
可通過產(chǎn)品設(shè)計控制�、產(chǎn)品原材料選擇、生產(chǎn)工藝過程控制����、產(chǎn)品技術(shù)性能指標的制定、模擬實驗、臨床試驗��、說明書�、正確的標簽標識等多項措施對風險進行控制,以降低風險至可接受水平���。
七��、說明書及標簽
具有針刺傷防護裝置的器械應(yīng)隨附正確使用器械所需的信息���,同時考慮使用者的培訓,以及識別制造商所需的信息�。
安全使用帶有針刺傷防護裝置的器械所需信息應(yīng)在每件器械的包裝上,或在銷售包裝上列出�����。如不能在每件器械的單個包裝上注明信息���,則應(yīng)在說明書中注明有關(guān)信息����。
使用說明書至少應(yīng)包含以下信息:
清楚描述如何激活防護裝置�����;
應(yīng)采取的預防措施或警告事項;
處置針刺傷防護器械的說明���。
八�����、參考資料
1.Guidance for Industry and FDA Staff Medical Devices with Sharps Injury Prevention Features. 2005.
2.ISO 23908:2011 Sharps injury protection -- Requirements and test methods -- Sharps protection features for single-use hypodermic needles, introducers for catheters and needles used for blood sampling.
3.Workbook for Designing, Implementing and Evaluating a Sharps Injury Prevention Program. CDC 2008.
九����、編寫單位
本指導原則由國家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評中心編寫并負責解釋��。